Bělousovova - Žabotinského reakce
 Potřebný materiál
Potřebný materiál
4 kádinky o objemu 100 ml
1 kádinka o objemu 200 ml
Magnetické míchadlo
Odměrné válce o objemu 5 a100 ml
Petriho miska
Roztok A 2,24 g KBrO3 v 60 ml 0,6 M H2SO4 ([BrO3-] = 0,5 M)
Roztok B 3,5 g kyseliny malonové v 50 ml H2O ([MA] = 0,5 M)
Roztok C 0,43 g KBr ve 23 ml H2O ([Br-] = 0,16 M)
Roztok D Ferroin – komerčně prodávaný roztok nebo vodný roztok o objemu 50 ml z 0,35 g heptahydrátu síranu železnatého a 0,88 g 1,10-fenantrolinu hydrochloridu rozpuštěných v 35 ml destilované vody.
Jak na to?
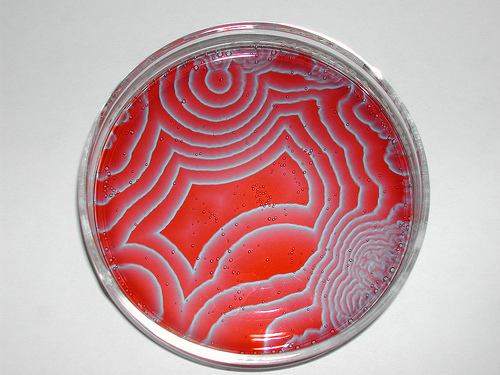
Roztoky A–C nalijeme do kádinky o objemu 200 ml. Po vymizení žlutohnědé barvy (bromu) přidáme 2 ml roztoku D (ferroinu), vhodíme magnetické míchadlo a postavíme na zapnutou míchačku. Bez promíchání můžeme také nalít malé množství roztoku na Petriho misku, kde se po chvíli začnou tvořit nepravidelné obrazce.
Výsledek
Ferroinový indikátor zbarví roztok do červena. Po zhruba 75 sekundách se barva roztoku změní na modrou, která je po nějakém čase opět vystřídána červenou. Takto reakce osciluje mezi modrou a červenou barvou.
Proč to tak je?
Bělousovova – Žabotinského (BZ) reakce je tzv. autokatalyzovaná oxidačně-redukční reakce. V základním uspořádání se jí účastní redoxní katalyzátor, organický substrát, který lze snadno bromovat a oxidovat, a bromičnanový iont ve formě NaBrO3 nebo KBrO3. To vše rozpuštěno v kyselém prostředí (roztoku kyseliny sírové nebo dusičné). Katalyzátorem byly v původní práci Ce3+/Ce4+ ionty, ale lze je nahradit ferroinem (jako v tomto pokusu) nebo Mn2+ ionty. Barevnou změnu způsobuje cyklická oxidace a redukce bromičnanových iontů na bromidové a zpět.
Doplňující informace
Tuto reakci objevil sovětský chemik Boris P. Bělousov v 50. letech 20. století. Ten si povšiml, že ve směsi bromičnanu draselného, síranu ceričitého a kyselin propionové a citronové ve zředěné kyselině sírové osciluje koncentrace ceričitých a ceritých iontů tak, že se směs střídavě zabarvuje žlutě a odbarvuje do bezbarvé formy. Takovýto typ reakce později potvrdil i další Rus, Anatolij Žabotinský. Oscilační reakce slouží jako učebnicový příklad nerovnovážné termodynamiky a také jako inspirace pro praktické aplikace – japonští vědci nedávno BZ reakci použili při výrobě oscilačních gelů, které lze využít v mikroreaktorech (viz Y Shiraki and R Yoshida, Angew. Chem., Int. Ed., 2012, DOI: 10.1002/anie.201202028).
Upozornění

 KBrO3 je silné oxidační činidlo – v kontaktu s hořlavými materiály může dojít k jeho vznícení. Silně toxický!
KBrO3 je silné oxidační činidlo – v kontaktu s hořlavými materiály může dojít k jeho vznícení. Silně toxický!

 Koncentrovaná kyselina sírová je silně toxická a leptavá.
Koncentrovaná kyselina sírová je silně toxická a leptavá.
 Kyselina malonová je silně dráždivá látka.
Kyselina malonová je silně dráždivá látka.
